Борьба за сохранение здоровья человечества — один из главных вызовов, стоящий перед нами на протяжении всей истории. Развитие медицины не только избавляет от болезней «здесь и сейчас», но и способствует улучшению общего уровня жизни, напрямую влияя на ее продолжительность.
Сегодня медицина — на пороге удивительных прорывов. Разработки в области нейроинтерфейсов типа мозг — компьютер, ксенотрансплантация органов (пересадка органов от животных человеку), развитие телехирургии — современным медикам есть чем удивлять. Однако с каждым годом жизнь привносит в их профессию новые нерешенные проблемы. Парадоксально, но появлению некоторых из этих проблем (таких как развитие антибиотикорезистентных бактерий), отчасти способствует сама медицина.
Мы собрали топ-5 наиболее значимых и перспективных медицинских технологий и подходов.
Прорывы биоинформатики в области вирусологии
В ХХІ веке переживает настоящий подъем биоинформатика. Это направление вычислительной микробиологии концентрируется на анализе структур биологических данных посредством их кодирования с последующей обработкой полученных массивов данных. С помощью математических алгоритмов и компьютерно-вычислительной техники биоинформатики строят математические модели и видят самые неявные взаимосвязи между мельчайшими клеточными структурами РНК и ДНК (рибонуклеиновой и дезоксирибонуклеиновой кислотами), формирующими геном всех биологических организмов.
Выявление взаимосвязей в геноме и процессов, отвечающих за механизмы поведения белковых структур, расширяет понимание о природе патогенных бактерий и вирусов. Одним из недавних достижений методов биоинформатики в области вирусологии стала успешная расшифровка природы механизма, ответственного за образование Tat-белков ВИЧ, опубликованная в Journal of Virology.
Известно, что множество белковых структур (доменов) обладают одновременно несколькими наборами функций. Tat-белок ВИЧ тоже является одним из таких. Его белковый домен, состоящий из девяти аминокислот, отвечает за выполнение сразу трех функций. Так, при прикреплении к РНК вирус способен создавать полноценные структуры новых вирусов, заражая все большее количество здоровых клеток. Еще одна функция Tat-белков ВИЧ — сигнал ядерной локализации (англ. Nuclear Localization Signal, NLS), который вирусный белок испускает, добравшись до клеточного ядра и запуская механизм размножения вируса. Механизм третьей функции Tat-белков пока не изучен, однако известно, что он отвечает за образование сигнала ядрышковой локализации (англ. Nucleolar Localization Signal, NoLS).
источник: rcsb.org
Построение математических моделей белкового домена вируса позволило определить набор механизмов его связи с ядром зараженной клетки. Перспектива понимания основ функционирования вирусных белков открывает дорогу к обозримой возможности блокировать механизм их работы, препятствуя делению ВИЧ, в особенности на ранних стадиях заражения.
Бесконтрольные мутации РНК-вирусов в некоторых случаях могут вредить сами себе. Скажем, ВИЧ, обладающий высокой скоростью мутагенеза, со временем накапливает пороговое значение мутаций и начинает производить деформированные белки, не способные создавать новые зараженные клетки.
Об этом эффекте впервые заговорил немецкий биохимик Манфред Эйген еще в 1971 году. Его научные работы в области мутагенеза вирусов дали старт многим исследованиям эффекта «катастрофы ошибок» в вирусах — специального состояния, при котором вирус мутирует настолько, что перестает быть опасным. Американские исследователи выяснили, что ВИЧ начинает производить «сломанные» белки после накопления всего 18 мутаций в своем геноме.
Есть все основания полагать, что накопительный эффект «катастрофы ошибок» может со временем сделать менее опасными (вплоть до полностью безвредных) такие вирусы, как SARS CoV-2, ВИЧ и ряд других РНК-вирусов. Но пока этого не случилось эволюционным путем, наличие вакцин будет необходимо.
м-РНК вакцины и обозримая победа над малярией
Хорошим примером развития технологий кодирования матричных-РНК являются вакцины против вируса SARS CoV-19 (и его штаммов) от компаний Pfizer и Moderna. Данные вакцины — инновационны, поскольку содержат в себе не ослабленную версию вируса (как векторные вакцины), а лишь синтезированную последовательность его РНК-кода. Иными словами, вакцина показывает организму, как запустить механизм выработки малого количества вирусных белков. Их, в свою очередь, атакует иммунная система человека, тренируясь и получая необходимый уровень иммунитета против вируса-возбудителя.
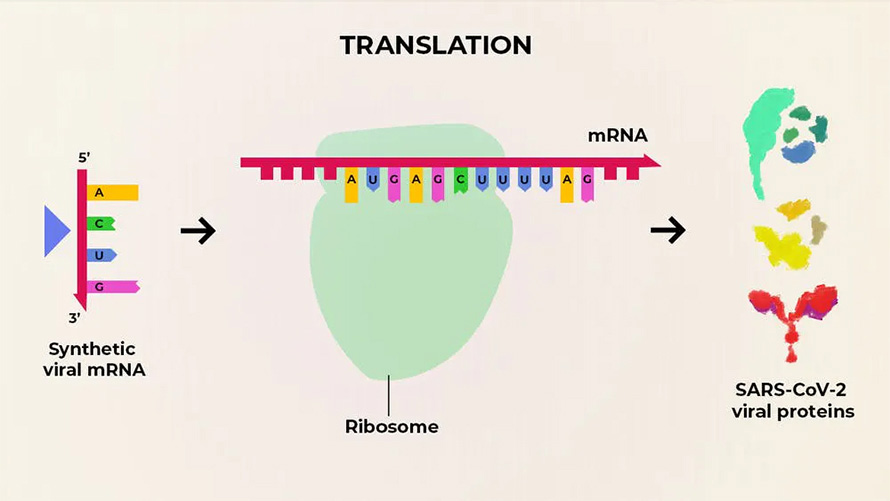
источник: The Conversation, CC BY-SA
Матричные РНК-вакцины хороши тем, что структуру синтезированных РНК-матриц можно легко изменять. А это позволяет делать наиболее актуальные сыворотки при возникновении новых штаммов вирусов. Матричные вакцины планируется применять не только для создания иммунитета от Covid-19. Ведутся исследования подобных вакцин для профилактики некоторых типов онкологии, ВИЧ и нескольких бактериальных инфекций по типу малярии.
Еще одним успехом в сфере вакцинации стало изобретение вакцины от малярии RTS,S/AS01 (фармацевтическое название Mosquirix), разработанной компанией GlaxoSmithKline. За плечами изобретателей вакцины — свыше 30 лет работы в области разработки иммунной защиты против бактерии-возбудителя малярии P. falciparum. В октябре 2021 года Всемирная организация здравоохранения (ВОЗ) рекомендовала использование вакцины для африканских детей, которые особенно страдают от последствий малярии: ежегодно она уносит 260 000 жизней детей до пяти лет в одной только Африке.
Механизм выработки антител в ответ на циркумспорозоитный белок (англ. Circumsporozoite Protein, CSP), вызывающий малярию, до конца не изучен, однако уже сейчас вакцина способна гарантировать от 30-50% образования иммунного ответа у вакцинированных детей. Средства на дальнейшие исследования вакцины RTS,S выделяются Альянсом по вакцинам GAVI, Глобальным фондом по борьбе со СПИДом, туберкулезом и малярией, а также ЮНИТЭЙД. Потому можно надеяться, что человечество увидит более действенные ее аналоги уже в обозримом будущем.
Успехи трансплантологии и развитие телемедицины
Еще одной областью, где вмешательство в геном принесло неимоверный успех, стала ксенотрансплантология. 10 января 2022 года на сайте Медицинского университета Мэриленда появилась новость о первой успешной пересадке человеку генномодифицированного сердца животного. 57-летнему пациенту Дэвиду Беннету (которому могла грозить скорая смерть от острой аритмии) пересадили сердце свиньи. К сожалению, вечером 8 марта Дэвид Беннет скончался, врачи не назвали точную причину смерти пациента.
Для того чтобы минимизировать риски отторжения органа от нового владельца, медикам пришлось совершить некоторые манипуляции с десятью генами: четыре гена свиньи были искусственно выключены, а шесть человеческих, напротив, активированы. Вмешательство в гены свиньи было осуществлено с целью сокращения рисков отторжения сердца иммунной системой его нового владельца, а также для того, чтобы купировать процесс роста свиного органа в человеческом теле.
источник: medschool.umaryland.edu
Развитие ксенотрансплантологии может нести как положительные, так и отрицательные последствия. Известно, что печень свиньи, пересаженная человеку, неуязвима к двум наиболее опасным вирусам гепатита (В и С). У этой медали имеется и обратная сторона: неизвестно, как инфекции, безвредные для животных, поведут себя в теле человека. Нет ясности и относительно функциональной полноценности органов животных: помещенные в человеческое тело, они могут не в полной мере выполнять все функции жизнеобеспечения. Это подтверждают исследования на приматах. Пока не будет окончательно изучена вся проблематика этого вопроса, операции по ксенотрансплантологии останутся скорее частным исключением, нежели повсеместным решением.
Еще одна перспективная область современной хирургии — телехирургия, которая стала возможной благодаря активному внедрению технологий беспроводного высокоскоростного подключения 5G. Она предполагает проведение дистанционного вмешательства хирурга посредством роботов-хирургов (со стороны пациента) и манипуляторов управления (со стороны врача). При этом низкая задержка сигнала у сетей связи последнего поколения позволяет хирургу быть на существенном отдалении от оперируемого. В марте 2019 года доктор Линь Чжипей из больницы общего профиля НОАК в Пекине успешно провел дистанционную операцию на мозге пациента, находившегося на расстоянии 1800 миль от хирурга.
В общем смысле телемедицина предполагает не только оперативное вмешательство, но и ведение консультативно-диагностической деятельности. В эпоху пандемии Covid-19 большинство национальных систем здравоохранения пошли именно по этому пути, предоставляя консультации своим пациентам, не покидавшим пределов своего дома. Важным фактором в успешности этой стратегии будет высокий уровень сбора и обработки биоматериалов пациента (медицинских анализов), которые в совокупности с жалобами больного помогут в постановке верного диагноза.
Нейронные интерфейсы, интегрируемые с мозгом
Продолжается работа над усовершенствованием интеграции искусственных нейронных интерфейсов типа мозг — компьютер (brain-computer interfaces, BIC). Предположительно, такие интерфейсы будут способны помочь парализованным людям вновь ощутить подвижность, управляя роботизированными протезами, или взаимодействовать с компьютером при помощи мысли и усилия воли.
Это становится возможным благодаря интеграции в мозг парализованного человека чипа, способного считывать электрические сигналы, исходящие от нейронов головного мозга. Продолжительный процесс практики позволяет человеку начать взаимодействовать с нейросетью чипа, общаясь через мозговые импульсы с программным алгоритмом, и давая ему команды, какое действие необходимо выполнить протезу-манипулятору.
Один из успешных тестировщиков — Нейтан Коупленд, доброволец с 90% параличом тела. Нейтан согласился принять участие в программе исследования нейроинтерфейса обратной связи, состоящего из группы имплантов-датчиков, вживленных в двигательную и осязательную кору его головного мозга. Наличие обратной связи в чипе позволяет Коупленду не только руководить манипулятором при помощи силы мысли, но и ощущать прикосновение протеза к предметам, их плотность и даже структуру, делая его первым в мире “осязаемым киборгом”.

источник: media-cldnry.s-nbcnews.com
Стоить отметить, что нейронные интерфейсы способны не просто влиять на качество жизни парализованных людей, но и использовать инновационные методики в лечении ряда психических заболеваний. Нейрочип, вживленный в мозг Сары (настоящее имя пациентки не разглашается), страдающей от терминальной стадии клинической депрессии, помог осуществить глубокую стимуляцию участков ее мозга (Deep Brain Stimulation, DBS), ответственных за возникновение депрессивных состояний.
Информация, полученная от нейронов Сары в момент острых приступов депрессии, читалась посредством специального нейрочипа, подключенного в мозг. При помощи алгоритмов AI (artificial intelligence — искусственный интеллект) смог расшифровать мозговые импульсы Сары, понять причины возникновения конкретно ее типа депрессии и помочь мозгу выработать нейронный ответ на сигналы угнетения. Данные прорывы стали возможными благодаря усилиям Хелен Майберг — нейрохирурга и пионера в области глубокой мозговой стимуляции.
Бактерии, антибактерии и Чарльз Дарвин
Согласно данным отчета «О глобальной устойчивости бактерий к противомикробным препаратам«, опубликованного в журнале Lancet в 2022 году, устойчивые к антибиотикам бактерии стали третьей причиной смертности в мире в 2019 году. Наиболее устойчивыми к действию большинства современных антибиотиков оказались следующие шесть патогенов: золотистый стафилококк и пневмококк, кишечная и синегнойная палочка, акинетобактерия Баумана и клебсиелла пневмонии.
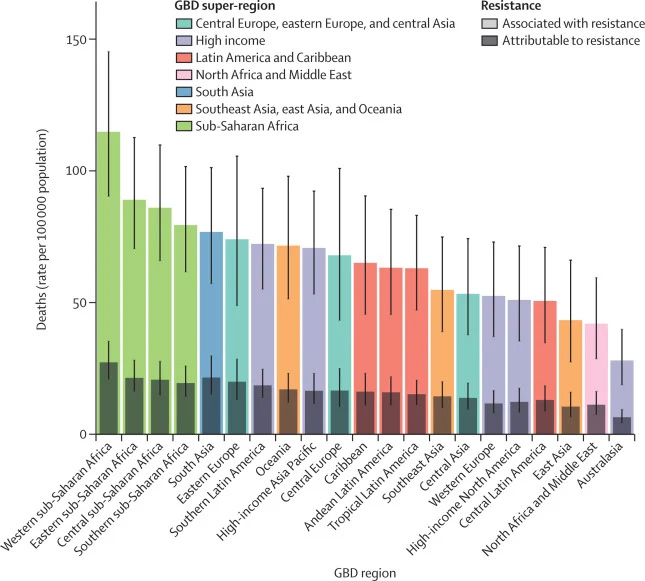
источник: Antimicrobial Resistance Collaborators, The Lancet, 2022
Но почему бактерии получают иммунитет к антибиотикам? Главную роль в этом процессе играет естественный отбор — эволюция бактерий. В местах с большой концентрацией как бактерий, так и антибиотиков всегда существует процент микробов, способных к адаптации в агрессивной среде. Такие бактерии не только выживают, но и сохраняют свою способность к делению. В 2016 году биологи Гарвардской медицинской школы смогли воссоздать этот механизм опытным путем. Всего за 11 дней они искусственно вывели колонии бактерий, резистентность к антибиотику у которых была в 1000 раз выше, чем у их предшественников. Для этого они поместили бактерии в искусственный контейнер, разделенный на девять секторов.

источник: wired.com
11 дней выживаемости бактерий в Harvard Medical School:
- Секторы 1 и 9 (начало эксперимента) — естественная среда
- Секторы 2 и 8 — х10 концентрация антибиотика в среде
- Секторы 3 и 7 — х100 концентрация антибиотика в среде
- Секторы 4, 5, 6 (конец эксперимента) — x1000 концентрация антибиотика в среде
Примечательно, что наиболее приспосабливаемые к антибиотику колонии бактерий были полностью неконкурентоспособными среди своих сородичей. Самые устойчивые к антибиотику бактерии одновременно оказывались слабее всех в условиях эволюционной гонки вне среды, содержащей антибиотик.
Безрецептурный и хаотичный прием антибиотиков является основным социальным фактором, влияющим на образование колоний супербактерий. Вот почему решение о необходимости приема антибиотиков всегда должно согласовываться с рекомендацией медиков. Помимо этого, важную роль в процессе сдерживания развития бактериальной устойчивости играет локализация инфекций в больницах и препятствование их выходу оттуда посредством повышенных требований санитарного контроля. Развитие уровня вакцинации против бактериальных инфекций, повышение качества очистки питьевой воды и отказ от антибиотиков в животноводстве способны существенно замедлить рост появления новых медикаментозно устойчивых мутаций микробов.
Предполагается, что в будущем ситуацию с резистентными бактериями станут решать не только новые виды более активных антибиотиков, но и возможность искусственно вмешаться в матричные РНК и ДНК резистентных бактерий, с целью дальнейшего редактирования их генома. Научно-медицинские исследования в этой области будут способны обратить эволюцию губительных патогенных структур вспять.






