Боротьба за збереження здоров’я людства — один із головних викликів, що стоїть перед нами протягом усієї історії. Розвиток медицини не тільки позбавляє хвороб “тут і зараз”, але й сприяє поліпшенню загального рівня життя, безпосередньо впливаючи на його тривалість.
Сьогодні медицина — на порозі дивовижних проривів. Розробки в галузі нейроінтерфейсів типу мозок-комп’ютер, ксенотрансплантація органів (пересадка органів від тварин людині), розвиток телехірургії — сучасні медики мають чим дивувати. Проте з кожним роком життя привносить у їхню професію нові невирішені проблеми. Парадоксально, але появі деяких із цих проблем (таких як розвиток антибіотикорезистентних бактерій), частково сприяє сама медицина.
Ми зібрали п’ятірку найбільш значущих і перспективних медичних технологій та підходів.
Прориви біоінформатики у галузі вірусології
У ХХІ столітті переживає справжнє піднесення біоінформатика. Цей напрямок обчислювальної мікробіології концентрується на аналізі структур біологічних даних, спираючись на їхнє кодування з подальшим обробленням отриманих масивів даних. За допомогою математичних алгоритмів та комп’ютерно-обчислювальної техніки біоінформатики будують математичні моделі та бачать найбільш неявні взаємозв’язки між найдрібнішими клітинними структурами РНК та ДНК (рибонуклеїновою та дезоксирибонуклеїновою кислотами), що формують геном усіх біологічних організмів.
Виявлення взаємозв’язків у геномі та процесів, що відповідають за механізми поведінки білкових структур, розширює розуміння природи патогенних бактерій і вірусів. Одним із недавніх досягнень методів біоінформатики в галузі вірусології стало успішне розшифрування природи механізму, відповідального за утворення Tat-білків ВІЛ, опубліковане в Journal of Virology.
Відомо, що багато білкових структур (доменів) мають відразу кілька наборів функцій. Tat-білок ВІЛ теж є одним із таких. Його білковий домен, що складається з дев’яти амінокислот, відповідає за виконання одночасно трьох функцій. Зокрема, при прикріпленні до РНК вірус здатний створювати повноцінні структури нових вірусів, заражаючи все більшу кількість здорових клітин. Ще одна функція Tat-білків ВІЛ — сигнал ядерної локалізації (англ. Nuclear Localization Signal, NLS), який вірусний білок надає, діставшись клітинного ядра і запускаючи механізм розмноження вірусу. Механізм третьої функції Tat-білків поки що не вивчений, проте відомо, що він відповідає за утворення сигналу ядерцевої локалізації (англ. Nucleolar Localization Signal, NoLS).
джерело: rcsb.org
Побудова математичних моделей білкового домену вірусу дозволила визначити набір механізмів зв’язку вірусу з ядром зараженої клітини. Перспектива розуміння основ функціонування вірусних білків відкриває дорогу до вірогідної можливості блокувати механізм їхньої роботи, перешкоджаючи поділу ВІЛ, особливо на ранніх стадіях зараження.
Безконтрольні мутації РНК-вірусів у деяких випадках можуть завдати шкоди самі собі. Так, ВІЛ, якому притаманна висока швидкість мутагенезу, з часом накопичує граничне значення мутацій і починає виробляти деформовані білки, котрі вже не мають здатності створювати нові заражені клітини.
Про цей ефект уперше заговорив німецький біохімік Манфред Ейген ще у 1971 році. Його наукові роботи в галузі мутагенезу вірусів поклали старт багатьом дослідженням ефекту “катастрофи помилок” у вірусах — спеціального стану, за якого вірус мутує настільки, що перестає бути небезпечним. Американські дослідники з’ясували, що ВІЛ починає виробляти “зламані” білки після накопичення лише 18 мутацій у своєму геномі.
Є всі підстави вважати, що накопичувальний ефект “катастрофи помилок” може згодом зробити менш небезпечними (аж до повністю нешкідливих) такі віруси, як SARS CoV-2, ВІЛ та низка інших РНК-вірусів. Але поки цього не сталося еволюційним шляхом, наявність вакцин буде необхідна.
м-РНК вакцини та осяжна перемога над малярією
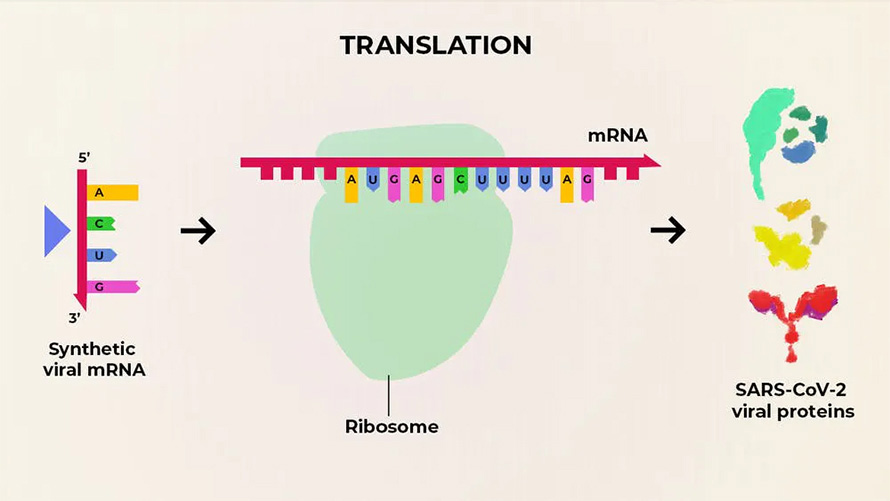
Хорошим прикладом розвитку технологій кодування матричних-РНК є вакцини проти вірусу SARS CoV-19 (і його штамів) від компаній Pfizer і Moderna. Дані вакцини інноваційні, оскільки містять у собі не ослаблену версію вірусу (як векторні вакцини), а лишень синтезовану послідовність його РНК-коду. Іншими словами, вакцина тільки показує організмові, як запустити механізм вироблення малої кількості вірусних білків. Їх, зі свого боку, атакує імунна система людини, тренуючись та отримуючи необхідний рівень імунітету проти вірусу-збудника.
джерело: The Conversation, CC BY-SA
Матричні РНК-вакцини хороші тим, що структуру їхніх синтезованих РНК-матриць можна легко змінювати. А це дозволяє виробляти найбільш дієві сироватки при виникненні нових штамів вірусів. Матричні вакцини планується застосовувати не тільки для створення імунітету від Covid-19. Провадяться дослідження подібних вакцин для профілактики деяких типів онкології, ВІЛ та кількох бактеріальних інфекцій на кшталт малярії.
Ще одним успіхом у сфері вакцинації став винахід вакцини від малярії RTS,S/AS01 (фармацевтична назва Mosquirix), розробленої компанією GlaxoSmithKline. За плечима винахідників вакцини — понад 30 років роботи у галузі розробки імунного захисту проти бактерії-збудника малярії P. falciparum. У жовтні 2021 року Всесвітня організація охорони здоров’я (ВООЗ) рекомендувала використання вакцини серед африканських дітей, які особливо страждають від наслідків малярії: щорічно вона забирає 260 000 життів дітей до п’яти років в одній лише Африці.
Механізм вироблення антитіл у відповідь на циркумспорозоітний білок (англ. Circumsporozoite Protein, CSP), що викликає малярію, до кінця не вивчений, проте вже зараз вакцина здатна гарантувати від 30-50% утворення імунної відповіді у вакцинованих дітей. Кошти на подальше дослідження вакцини RTS,S виділяються Альянсом із вакцин GAVI, Глобальним фондом боротьби зі СНІДом, туберкульозом і малярією, а також ЮНІТЕЙД. Тож можна сподіватися, що людство побачить більш дієві її аналоги вже у найближчому майбутньому.
Успіхи трансплантології та розвиток телемедицини
Ще однією областю, де втручання у геном принесло неймовірний успіх, стала ксенотрансплантологія. 10 січня 2022 року на сайті Медичного університету Меріленда з’явилася новина про першу успішну пересадку людині генномодифікованого серця тварини. 57-річному пацієнтові Девіду Беннету (якому могла загрожувати швидка смерть від гострої аритмії) пересадили серце свині. Нажаль, увечері 8 марта Девід Беннет помер, лікарі не назвали точну причину смерті пацієнта.
Для того щоб мінімізувати ризики відторгнення органа від нового власника, медикам довелося вдатися до деяких маніпуляцій із десятьма генами: чотири гени свині були штучно вимкнені, а шість людських, навпаки, активовані. Втручання в гени свині здійснили з метою скорочення ризиків відторгнення серця імунною системою його нового власника, а також для того, щоб зупинити безконтрольний процес зростання свинячого органа в людському тілі.
джерело: medschool.umaryland.edu
Розвиток ксенотрансплантології може мати як позитивні, так і негативні наслідки. Відомо, що печінка свині, пересаджена людині, невразлива до двох найбільш небезпечних вірусів гепатиту (В та С). У цієї медалі є й зворотний бік: невідомо, як інфекції, нешкідливі для тварин, поведуть себе в тілі людини. Нез’ясованою залишається і функціональна повноцінність органів тварин: переміщені в людське тіло, вони можуть не повною мірою виконувати всі функції життєзабезпечення. Це підтверджують дослідження на приматах. Поки не буде цілковито вивчена вся проблематика цього питання, операції з ксенотрансплантології залишаться скоріше виключенням, аніж повсюдним рішенням.
Ще одна перспективна галузь сучасної хірургії — телехірургія, яка стала можливою завдяки активному впровадженню технологій бездротового високошвидкісного підключення 5G. Вона передбачає проведення дистанційного втручання хірурга за допомогою роботів-хірургів (з боку пацієнта) та маніпуляторів управління (з боку лікаря). При цьому низька затримка сигналу у мереж зв’язку останнього покоління дозволяє хірургу перебувати на істотному віддаленні від оперованого. У березні 2019 року лікар Лінь Чжипей з лікарні загального профілю НВАК у Пекіні успішно провів дистанційну операцію на мозку пацієнта, що перебував на відстані 1800 миль від хірурга.
Загалом телемедицина передбачає як оперативне втручання, так і ведення консультативно-діагностичної діяльності. В епоху пандемії Covid-19 більшість національних систем охорони здоров’я пішли саме цим шляхом, надаючи консультації своїм пацієнтам, які не залишали меж свого будинку. Важливим фактором успішності цієї стратегії буде високий рівень збору та обробки біоматеріалів пацієнта (медичних аналізів), які сукупно зі скаргами хворого допоможуть встановлювати вірний діагноз.
Нейронні інтерфейси, що інтегруються з мозком
Продовжується робота над удосконаленням інтеграції штучних нейронних інтерфейсів типу мозок — комп’ютер (brain-computer interfaces, BIC). Імовірно, такі інтерфейси будуть здатні допомогти паралізованим людям знову відчути рухливість, керуючи роботизованими протезами, або взаємодіяти з комп’ютером за допомогою думки та зусилля волі.
Це стає можливим завдяки інтеграції в мозок паралізованої людини чипа, здатного зчитувати електричні сигнали, що надходять від нейронів головного мозку. Тривалий процес тренувань дає людині змогу почати взаємодіяти з нейромережею чипа, спілкуючись через мозкові імпульси з програмним алгоритмом і надсилаючи йому команди щодо того, яку дію необхідно виконати протезу-маніпулятору.
Одним із успішних тестувальників цієї технології є Нейтан Коупленд, доброволець із 90% паралічем тіла. Нейтан погодився взяти участь у програмі дослідження нейроінтерфейсу зворотного зв’язку, що складається з групи імплантів-датчиків, вживлених у рухову та дотичну кору його головного мозку. Наявність зворотного зв’язку в чипі дозволяє Коупленду не тільки керувати маніпулятором за допомогою сили думки, але й відчувати дотик протеза до предметів, їхню щільність і навіть структуру, роблячи його першим у світі “чутливим кіборгом“.

джерело: media-cldnry.s-nbcnews.com
Варто відзначити, що нейронні інтерфейси здатні не лише впливати на якість життя паралізованих людей, але й використовувати інноваційні методики в лікуванні психічних захворювань. Нейрочип, вживлений у мозок Сари (справжнє ім’я пацієнтки не розголошується), хворої на клінічну депресію, допоміг здійснити глибоку стимуляцію ділянок її мозку (Deep Brain Stimulation, DBS), відповідальних за виникнення депресивних станів.
Інформація, отримана від нейронів Сари в момент гострих нападів депресії, читалася за допомогою спеціального нейрочипа, який вживили у мозок. Спираючись на алгоритми, AI (artificial intelligence — штучний інтелект) зміг розшифрувати мозкові імпульси Сари, зрозуміти причини виникнення саме її типу депресії та допомогти мозку розробити нейронну відповідь на сигнали пригнічення. Дані прориви стали можливими завдяки зусиллям Хелен Майберг — нейрохірурга та піонера в галузі глибокої мозкової стимуляції.
Бактерії, антибактерії та Чарльз Дарвін
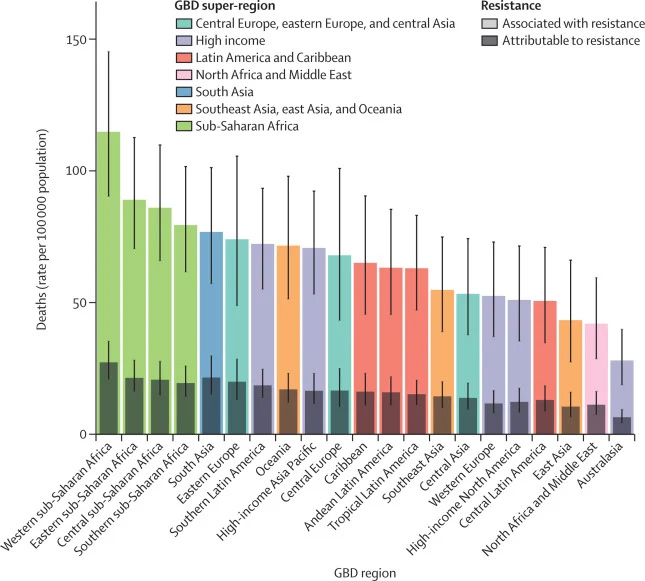
Згідно з даними звіту “Про глобальну стійкість бактерій до протимікробних препаратів“, опублікованого в журналі Lancet 2022 року, стійкі до антибіотиків бактерії стали третьою причиною смертності у світі у 2019 році. Найбільш стійкими до дії більшості сучасних антибіотиків виявилися наступні шість патогенів: золотистий стафілокок і пневмокок, кишкова та синьогнійна паличка, акинетобактерія Баумана та клебсієла пневмонії.
джерело: Antimicrobial Resistance Collaborators, The Lancet, 2022
Але чому бактерії набувають імунітету до антибіотиків? Головну роль у цьому відіграє процес природного відбору — еволюція бактерій. У місцях з великою концентрацією як бактерій, так і антибіотиків завжди існує відсоток мікробів, здатних до адаптації до агресивного середовища. Такі бактерії не лише виживають, а й зберігають свою здатність до поділу. У 2016 році біологи Гарвардської медичної школи змогли відтворити цей механізм емпірично. Всього за 11 днів вони штучно вивели колонії бактерій, резистентність до антибіотика у яких була в 1000 разів вищою, ніж у їхніх попередників. Для цього вони помістили бактерії у штучний контейнер, поділений на дев’ять секторів.

джерело: wired.com
11 днів виживання бактерій у Harvard Medical School:
- Сектори 1 і 9 (початок експерименту) — природне середовище
- Сектори 2 та 8 — х10 концентрація антибіотика в середовищі
- Сектори 3 та 7 — х100 концентрація антибіотика в середовищі
- Сектори 4, 5, 6 (кінець експерименту) — x1000 концентрація антибіотика в середовищі
Примітно, що найбільш пристосовані до антибіотика колонії бактерій були повністю неконкурентоспроможними серед своїх родичів. Найстійкіші до антибіотика бактерії водночас виявлялися найслабшими в умовах еволюційних перегонів поза середовищем, що містить антибіотик.
Безрецептурне та хаотичне вживання антибіотиків є основним соціальним фактором, що впливає на утворення колоній супербактерій. Ось чому рішення щодо необхідності прийому антибіотиків завжди має узгоджуватися з рекомендацією медиків. Окрім цього, важливу роль у стримуванні розвитку бактеріальної стійкості відіграє локалізація інфекцій у лікарнях і перешкоджання їхньому виходу звідти за допомогою підвищених вимог санітарного контролю. Розвиток рівня вакцинації проти бактеріальних інфекцій, підвищення якості очищення питної води та відмова від антибіотиків у тваринництві здатні також суттєво уповільнити зростання появи нових медикаментозно стійких мутацій мікробів.
Передбачається, що у майбутньому ситуацію з резистентними бактеріями вирішуватимуть як нові види більш активних антибіотиків, так і можливість штучно втрутитися в матричні РНК і ДНК резистентних бактерій, з подальшою змогою редагування їхнього генома. Науково-медичні дослідження у цій галузі будуть здатні повернути еволюцію згубних патогенних структур навспак.






